هلیم (Helium) با نشان شیمیایی He یک عنصر شیمیایی با عدد اتمی ۲ و وزن اتمی ۴٫۰۰۲۶۰۲ است. این عنصر، بی بو، بی رنگ، بی مزه، غیرسمّی، از دیدگاه شیمیایی بی اثر و تک اتمی است که در جدول تناوبی استاندارد در بالای گروه گازهای نجیب جا دارد. دمای ذوب و جوشاین ماده در میان دیگر عنصرها بسیار پایین است به همین دلیل در دمای اتاق و البته در بیشتر موارد به صورت گازی است مگر شرایط بسیار ویژهای بر آن گذرانده شود.
هلیم بعد از هیدروژن دومین عنصر سبک جهان است و از لحاظ فراوانی هم باز بعد از هیدروژن در جایگاه دوم قرار میگیرد. نزدیک به ۲۴٪ از جرمگیتی از آن این عنصر است که این مقدار بیش از ۱۲ برابر ترکیب تمام عنصرهای سنگین است. هلیم به همان صورت که در خورشید و مشترییافت میشود در جهان پیدا میشود و این به دلیل انرژی بستگی (به ازای هر هسته) بسیار بالای هلیم-۴ نسبت به سه عنصر دیگر پس از آن در جدول تناوبی است. بیشتر هلیم موجود در گیتی، هلیم-۴ است و گمان آن میرود که در جریان مه بانگ پدید آمده باشد. امروزه با کمک واکنشهای همجوشی هستهای در ستارهها، گونههای تازهای از هلیم ساخته شدهاست.
واژهٔ هلیوم از واژهٔ یونانی هلیوس به معنای «ایزد خورشید» گرفته شدهاست. زمانی که هنوز هلیم شناخته نشده بود، ستاره شناس فرانسویژول ژانسن در جریان خورشیدگرفتگی سال ۱۸۶۸ برای نخستین بار در طیفسنجی نور خورشید، خط زرد طیفی هلیم را دید; برای همین، هنگامی که از نخستین کسانی که هلیم را شناسایی کردند یاد میشود نام ژول ژانسن در کنار نام نورمن لاکیر جای میگیرد. در جریان همان خورشیدگرفتگی، نورمن لاکیر پیشنهاد کرد این خط زرد میتواند به دلیل یک عنصر تازه باشد. دو شیمیدان سوئدی با نامهای پر تئودر کلیو و نیلز آبراهام لانگلت در سال ۱۸۹۵ این عنصر را شناسایی و اعلام کردند. آنها هلیم را از سنگ کلویت که معدن اورانیم است بدست آوردند. در سال ۱۹۰۳ منابع بزرگ هلیم در میدانهای گازی ایالات متحده پیدا شد که یکی از بزرگترین منابع این گاز است.
یکی از کاربردهای مهم هلیم در سرماشناسی است. نزدیک به یک-چهارم هلیم تولیدی در این زمینه بکار میرود. ویژگی خنک سازی هلیم به ویژه در خنک کردن آهنرباهای ابررسانا مهم است. این آهن رباها به صورت تجاری در اسکنرهای ام آر آی کاربرد دارد. کاربرد صنعتی دیگر هلیم در فشار وارد کردن برای نمونه به عنوان گاز تخلیه کنندهاست. همچنین به عنوان هوای محافظ در جوشکاری با قوس الکتریکی، در فرایندهایی مانند کشت بلورها در ساخت قرصهای سیلیسیم از این گاز بهره برده میشود. نزدیک به نیمی از هلیم تولیدی در این زمینه کاربرد دارد.
یکی دیگر از کاربردهای شناخته شدهٔ هلیم در ویژگی بالابری در بالونها و کشتیهای هوایی است.[۲] تنفس حجم اندکی از گاز هلیم میتواند برای چندی در کیفیت و زنگ صدای انسان تاثیر بگذارد. این اثرگذاری تنها از آن هلیم نیست بلکه هر گازی که چگالی متفاوتی با هوا داشته باشد از این ویژگی برخوردار است. در پژوهشهای دانشگاهی رفتار دو فاز سیال هلیم-۴ (هلیمI و هلیمII) در بحثهای مربوط بهمکانیک کوانتوم و یا پژوهش دربارهٔ پدیدههایی مانند ابررسانایی که با دماهای نزدیک به صفر مطلق در ماده کار میکند، مهم است.
هلیم در هواکُرهٔ زمین بسیار کمیاب است (نزدیک به ۰٫۰۰۰۵۲٪ حجمی) بیشتر هلیومی که در خاک زمین پیدا میشود در اثر واپاشی هستهای طبیعی در عنصرهای سنگین پرتوزا مانند اورانیم و توریم پدید آمدهاست؛ به این ترتیب که در اثر واپاشی، ذرههای بتا از عنصر تابیده شده و هستهٔ هلیم-۴ بدست آمدهاست. هلیم بدست آمده از واپاشی به آسانی به صورت فشرده با درصدی نزدیک به ۷٪ حجمی، در دام گاز طبیعی گرفتار میشود. سپس می توان با روشهای صنعتی و به صورت تجاری با کاهش دمای آمیختهٔ هلیم و گاز طبیعی، هلیم را از دیگر گازها جدا ساخت. این روش تقطیر جزء به جزء نام دارد.
تاریخچه
نخستین نشانهٔ هلیم در ۱۸ اوت سال ۱۸۶۸ به صورت یک میلهٔ زرد رنگ در طول موج ۵۸۷٫۴۹ نانومتر در طیف سنجی فامسپهر خورشید دیده شد. این خط زرد رنگ را ستاره شناس فرانسوی ژول ژانسن در هنگام یک خورشیدگرفتگی کامل در گونتور هند شناسایی کرد. نخست گمان برده شد که شاید این خط زرد، سدیم است. در ۲۰ اکتبر همان سال، ستاره شناس انگلیسی، نورمن لاکیر یک خط زرد رنگ در طیف سنجی نور خورشید پیدا کرد و چون این خط نزدیک به خطهای شناخته شدهٔ D۱ و D۲ سدیم بود، آن را D۳ خطهای فرانهوفر نامید. او حدس زد که این خط باید توسط یک عنصر درون خورشید که در زمین ناشناختهاست، پدید آمده باشد. لاکیر و شیمیدان انگلیسی ادوارد فرانکلند واژهٔ یونانی ἥλιος (هلیوس) به معنی «خورشید» را برای این عنصر برگزیدند.
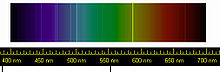
خطهای طیفی هلیم
در ۱۸۸۲، فیزیکدان ایتالیایی، لوئیجی پالمیری، هنگامی که خطهای طیفی D۳ گدازههایآتشفشان وزوو را پردازش میکرد توانست برای نخستین بار هلیم را در زمین شناسایی کند.
در ۲۶ مارس ۱۸۹۵ شیمیدان اسکاتلندی ویلیام رمزی توانست، هلیم کانی کلویت را با کمکاسیدهای معدنی، به دام اندازد. کلویت آمیختهای از اورانیت و دست کم ۱۰٪ عنصرهای خاکی کمیاب است. رمزی در جستجوی آرگون بود اما پس از جداسازی نیتروژن و اکسیژن از گاز آزاد شده با کمک اسید سولفوریک، در طیف سنجی خود به یک خط زرد روشن رسید که با خط D۳ دیده شده در طیف سنجی خورشید هماهنگ بود. این نمونهها از سوی لاکیر و فیزیکدان بریتانیایی، ویلیام کروکز به عنوان هلیم شناسایی شد. در همان سال به صورت مستقل، دو شیمیدان با نامهای پر تئودر کلیو و نیلز آبراهام لانگلت، در اوپسالای سوئد توانستند هلیم کلویت را به دام اندازند. آنها به اندازهٔ کافی این گاز را جمع آوری کردند که بشود وزن اتمی آن را دقیق بدست آورد. دانشمند آمریکایی زمینشیمی، ویلیام فرانسیس هیلبرند پیش از دست آورد رمزی، هنگام طیف سنجی نمونه کانیهای اورانیت دریافته بود که خطهای طیفی غیرمعمولی در نتیجههایش پیدا میشود. اما هیلبرند گمان کرد که این خطهای طیفی مربوط به نیتروژن است. نامهٔ تبریک او به رمزی چیزی نزدیک به یک کشف علمی در نظر گرفته میشود.
در سال ۱۹۰۷ ارنست رادرفورد و توماس رویدز نشان دادند که ذرههای آلفا همان هستهٔ هلیم اند. آنها برای این کار، اجازه دادند تا ذرهها در دیوار شیشهای نازک یک لولهٔ تهی نفوذ کند. سپس لوله را تخلیه کردند تا گاز تازهٔ جمع شده در آن را طیف سنجی کنند. در سال ۱۹۰۸ یک فیزیکدان هلندی به نام هایک کامرلینگ اونس توانست دمای هلیم را به زیر یک کلوین برساند و آن را مایع کند. و در ادامه تلاش کرد تا دمای هلیم را پایین تر آورد و آن را جامد کند اما کامیاب نشد. دلیل ناکامی او این بود که هلیم دارای نقطهٔ سهگانه نیست یعنی دارای دمایی نیست که در آن حالتهای جامد، مایع و گازی در تعادل باشند. پس از چند سال، در ۱۹۲۶ ویلم هندریک کییزم که دانشجوی اونس بود توانست 1 cm۳ هلیم را با افزودن فشار، جامد کند.
در ۱۹۳۸، فیزیکدان روس، پیوتر کاپیتسا دریافت که در دمای نزدیک به صفر مطلق، هلیم-۴ تقریباً هیچ گرانروی ندارد، امروزه به این پدیده ابرروانروی می گوییم. این پدیده با چگالش بوز-اینشتین مرتبط است. در ۱۹۷۲ همین پدیده در هلیم-۳ هم دیده شد، اما این بار در دمایی بسیار نزدیک تر به صفر مطلق. دانشمندان آمریکایی داگلاس دین اشرفت، دیوید موریس لی و رابرت کلمن ریچاردسون کسانی بودند که به ابرروانروی در هلیم-۳ پی بردند. گمان آن میرود که این پدیده در هلیم-۳ به جفت فرمیونها در ساخت بوزون، در برابر جفتهای کوپر الکترونها که پدیدآورندهٔ ابررسانایی است، ارتباط داشته باشد
هلیم، پس از نئون، کم واکنش ترین گاز نجیب و البته دومین عنصر کم واکنش پذیر در میان همهٔ عنصرها است.[۲۰] این گاز کم واکنش، در همهٔ شرایط استاندارد به صورت تکاتمی باقی میماند. هلیم به دلیل داشتن جرم مولی نسبتاً پایین، دارای رسانش گرمایی و ظرفیت گرمایی بالایی است و سرعت صدا هم در آن، در حالت گازی، از هر گاز دیگری به جز هیدروژن، بالاتر است. همچنین به دلیل همانند و به دلیل کوچکی اندازهٔ اتم هلیم، نرخ پخش در اجسام جامد، سه برابر بیشتر از نرخ پخش هوا و برابر با ۶۵٪ نرخ پخش هیدروژن است.[۵]
هلیم نسبت به دیگر گازهای تک اتمی از همه کمتر در آب حل میشود. و نسبت به دیگر گازها، می توان گفت یکی از کم حل شدنی ترین گازها است؛ ضریب حلالیت این گاز 0.70797 x۲/۱۰−۵ است که از CF۴ و SF۶ و C۴F۸ که به ترتیب دارای میزان حلالیتهای ۰٫۳۸۰۲ و ۰٫۴۳۹۴ و 0.2372 x۲/۱۰−۵ اند، بیشتر است (مول). ضریب شکست هلیم بیش از هر گاز دیگری به یک نزدیک است. ضریب ژول-تامسون هلیم در دمای معمولی پیرامونش، منفی است به این معنی که اگر اجازه دهیم این گاز آزدانه افزایش حجم پیدا کند، گرم تر میشود. اما اگر هلیم در زیر دمای واژگون ژول-تامسون (در حدود ۳۲ تا ۵۰ کلوین در یک اتمسفر) باشد، اگر اجازه داشته باشد آزادانه افزایش حجم پیدا کند، دمای آن پایین میآید. با توجه به این ویژگی اگر دمای هلیم از این دما پایین تر آماده باشد، می توان با افزایش حجم، آن را خنک و مایع کرد.
بیشتر هلیم فرازمینی (بیرون از کرهٔ زمین) در حالت پلاسما یافت میشود. در این حالت، ویژگیهای ماده بسیار متفاوت از ویژگیهای حالت اتمی آن است. در حالت پلاسما، الکترونها دیگر در بند هسته نیستند درنتیجه دارای رسانایی الکتریکی بسیار بالایی خواهد بود حتی اگر تنها بخشی از آن یونی شده باشد. ذرههای باردار به شدت از میدان مغناطیسی و الکتریکی پیرامون تاثیر میپذیرند. برای نمونه در بادهای خورشیدی با هیدروژن یونی، ذرهها بامغناطکرهٔ زمین اندرکنش پیدا میکند و باعث پدید آمدن شفق قطبی و جریان بیرکلند میشود.
حالتهای مایع و جامد
برخلاف دیگر عنصرها در فشار معمولی، هلیم تا دمای صفر مطلق، همچنان مایع باقی میماند. دلیل این پدیده را می توان با مکانیک کوانتوم توضیح داد: بویژه انرژی نقطهٔ صفر این سامانه بسیار بالا است برای اینکه بخواهد اجازه دهد هلیم جامد شود. هلیم برای جامد شدن باید به دمایی میان ۱ تا ۱٫۵ کلوین (۴۵۷- فارنهایت یا ۲۷۲- سلسیوس) و فشاری نزدیک به ۲٫۵ مگاپاسکال برسد. معمولاً شناسایی هلیم جامد از مایع کمی دشوار است چون ضریب شکست هر دو بسیار نزدیک است. هلیم در حالت جامد دارای نقطهٔ ذوب دقیق است، ساختار بلوری دارد و بسیار تراکم پذیر است تا حدی که با وارد کردن فشار بر آن می توان تا بیش از ۳۰ درصد حجم آن را کاهش داد.[۲۶] ضریب کشسانی حجمی آن نزدیک به ۲۷ مگاپاسکال است که تقریباً ۱۰۰ برابر بیشتر از آب تراکم پذیر است. چگالی هلیم جامد در دمای ۱٫۱ کلوین و فشار ۶۶ اتمسفر، ۰٫۲۱۴ ± ۰٫۰۰۶ g/cm۳ و در دمای صفر کلوین و فشار ۲۵ بار (۲٫۵ مگاپاسکال)، ۰٫۱۸۷ ± ۰٫۰۰۹ g/cm۳ است.
ایزوتوپ
تا کنون ۸ ایزوتوپ برای هلیم پیدا شدهاست. که از میان آنها هلیم-۳ و هلیم-۴ تنها ایزوتوپهای پایدار آن اند. در هواکرهٔ زمین در برابر هر یک اتم هلیم-۳ یک میلیون هلیم-۴ وجود دارد. برخلاف بیشتر عنصرها، فراوانی ایزوتوپهای هلیم بسته به منبع تولید و فرایند پدیداری شان بسیار متفاوت است. فراوان ترین ایزوتوپ آن، هلیم-۴ در زمین از راه واپاشی آلفای عنصرهای پرتوزای سنگین تر تولید میشود. پرتوهای آلفای تابیده شده همگی هستههای یونیزه شدهٔ هلیم-۴ اند. هلیم-۴ به طرز غیرمعمولی هستهٔ پایداری دارد چون ذرههای هستهای آن از آرایش الکترونی پایداری برخوردازند. این ایزوتوپها در جریان هستهزایی مهبانگ به فراوانی تولید شدند.
هلیم-۳ به مقدار بسیار ناچیز یافت میشود که بیشتر آن از هنگامهٔ ساخت زمین به جای مانده. گاهی هم هلیم گیر افتاده در گرد و غبار کیهانی هم وارد زمین شدهاست. همچنین در اثر واپاشی بتای تریتیوم هم اندکی هلیم-۳ تولید میشود در سنگهای پوستهٔ زمین ایزوتوپهایی از هلیم پیدا میشود که نسبت یک به ده دارد با توجه به این نسبتها می توان دربارهٔ منشا سنگها و ساختار گوشتهٔ زمین پژوهش کرد. هلیم بیش از همه به عنوان محصول واکنشهای همجوشی در ستارهها پیدا میشود. بنابراین در محیطهای میان ستارهای نسبت هلیم-۳ به هلیم-۴ نزدیک به صد برابر بیشتر از نسبت آن در زمین است. در مادههای فرازمینی مانند سنگهای موجود در ماه یا سیارکها می توان ردّ پای هلیم-۳ را از هنگامی که در اثر بادهای خورشیدی پرتاب شدند، پیدا کرد. غلظت هلیم-۳ موجود در ماه، ۰٫۰۱ ppm است (یک بخش در میلیون) که بسیار بالاتر از مقدار آن، ۵ ppt در هواکرهٔ زمین است (یک بخش در تریلیون). دستهای از جملهٔ آنها جرارلد کالسینسکی در سال ۱۹۸۶ پیشنهاد دادند که در سطح ماه جستجو شود و از معدنهای هلیم-۳ آن برای واکنش همجوشی هستهای بهره برداری شود.
هلیم-۴ مایع را می توان با کمک کولرهای آبی ویژه تا نزدیک به ۱ کلوین سرد کرد. روش سردسازی هلیم-۳ مانند هلیم-۴ است با این تفاوت که هلیم-۳ نقطهٔ جوش پایین تری، نزدیک به ۰٫۲ کلوین دارد و این فرایند در سردساز هلیم-۳ روی میدهد. اگر بخواهیم مخلوطی از هلیم-۳ و هلیم-۴ با نسبتهای برابر در زیر ۰٫۸ کلوین داشته باشیم این دو به به دلیل ناهمانندی به صورت دو بخش مخلوط نشدنی از هم جدا میشوند (اتمهای هلیم-۴ را بوزونها تشکیل میدهد در حالی که در هلیم-۳ فرمیونها سازندهٔ اتمهایند. ( این ویژگی هلیم در یخچالهای رقیقسازی برای رسیدن به دمای چند میلی کلوین به کار میآید.
می توان به صورت آزمایشگاهی هم ایزوتوپ هلیم درست کرد اما این ایزوتوپها خیلی زود به دیگر مادهها دگرگون میشوند. برای نمونه می توان از هلیم-۵ یاد کرد که دارای کوتاه ترین نیمهعمر،۷٫۶×۱۰−۲۲ ثانیهاست. پس از آن هلیم-۶ است که تابش بتا و نیمه عمر ۰٫۸ ثانیه دارد. هلیم-۷ ذرات بتا و پرتوی گاما می تاباند. هلیم-۷ و هلیم-۸ هر دو در شرایط ویژهٔ واکنشهای هستهای پدید میآیند. هلیم-۶ و هلیم-۸ هر دو با نام Nuclear halo هم شناخته شدهاند. به این معنی که شعاع بدست آمده برای آنها بسیار بیشتر از مقدار پیش بینی شده توسط مدلهای اندازه گیری برای نمونه liquid drop model) )است.
کاربرد
هیلم دارای ویژگیهای یکتایی است که در بسیاری جاها به آن نیاز است. این ویژگیهای هلیم عبارتند از: نقطهٔ جوش، چگالی و حل شوندگی پایین، رسانش گرمایی بالا و واکنش ناپذیر بودن آن. هلیوم منبع تجدید ناپذیر است و با آزاد شدن آن به اتمسفر دیگر امکان بازیابی آن وجود ندارد. در حال حاضر عمر منابع هلیوم به ذخایر گاز طبیعی وابسته است و پیش بینی میشود بهای هلیوم در آینده همچنان سیر صعودی داشته باشد. از سال ۲۰۰۸ میزان تولید هلیم، ۳۲ میلیون کیلوگرم یا ۱۹۳ میلیون مترمکعب در سال بودهاست که بیشترین کاربرد آن (نزدیک به ۲۲ درصد کل در سال ۲۰۰۸) در کاربردهای سردکننده بویژه در آهنربای ابررسانا در دستگاههای امآرآی است. دیگر کاربردهای مهم آن (۷۸ درصد کل در سال ۱۹۹۶) برای ایجاد فشار، هوای پیرامونی کنترل شده و جوشکاری بودهاست.
هوای محیطی کنترل شده:
هلیم به دلیل ویژگی واکنش ناپذیری، به عنوان یک گاز محافظ در کشت بلورهای سیلیسیم و ژرمانیم، تولید در تیتانیم و زیرکونیم و در کروماتوگرافی گازی به کار میآید. همچنین به دلیل داشتن ویژگیهای نزدیک به طبیعت گاز ایدهآل، سرعت بالای صدا در آن و نسبت ظرفیت گرمایی بالا، برای کاربرد در تونلهای باد فراصوتی و ابزارهای آزمون افزایش ناگهانی آنتالپی (Impulse facility) مورد نیاز است.
جوشکاری با گاز محافظ و الکترود هلیم
در فرایند جوشکاری با قوس الکتریکی بر روی موادی که در دمای جوشکاری در اثر تماس با هوا یا نیتروژن دچار آسیب میشوند به عنوان لایهٔ محافظ یا پوشش عمل میکند. گازهای گوناگونی در جوشکاری با قوس الکتریکی به عنوان گاز محافظ به کار میروند که هلیم به جای آرگون ارزان، بویژه برای موادی که رسانش گرمایی بالاتری دارند مانند آلومینیم و مس بکار میرود.
کاربرد های کوچکتر:
تشخیص محل نشت:
یک کاربرد صنعتی هلیم، تشخیص جای نشت است. چون هلیم توان پخش شدن خوبی از میانهٔ بدنهٔ جامد دارد، سه بار تندتر از هوا، برای همین به عنوان گازی که میتواند محل نشت را ردیابی کند، بکار میرود. برای نمونه می توان از مخزنهای فشارهای بالا یا ابزارهای سردکننده یاد کرد. برای تشخیص جای نشت یک ابزار، آن را درون یک محفظه که اول کاملاً تهی شده و سپس از هلیم پر شده، میگذارند. هلیمی که از محلهای نشت رد شده را با کمک ابزار طیف سنجی جرمی هلیم شناسایی میکنند. این ابزار بسیار دقیق است و دقت آن به ۱۰−۹ mbar·L/s یا ۱۰−۱۰ Pa·m3/sهم میرسد. این فرایند اندازه گیری معمولاً به صورت خودکار انجام میشود و در اصطلاح به آن helium integral test می گویند. یک فرایند ساده تر شناسایی نشت، پر کردن وسیلهٔ مورد نظر از هلیم است برای این کار پس از پر کردن، باید با ابزارهای دستی محل نشت را جستجو کرد.
هلیمی که از ترکهای یک وسیله میگذرد را نباید با نفوذ گاز از بدنهٔ ماده اشتباه گرفت. ثابت نفوذ هلیم از بدنهٔ مواد (شیشه، سرامیک و مواد آزمایشگاهی)، مشخص است و ضریب گذر آن قابل محاسبهاست. البته بیشتر گازهای بی اثر مانند گازهای نجیب و نیتروژن و البته هلیم، از بدنهٔ بیشتر مواد نمیتوانند بگذرند.
پرواز
چون هلیم از هوا سبکتر است (نزدیک به ۷ درصد شناوری بیشتری دارد)، برای به هوا رفتن کشتیهای هوایی و بالونها به گاز هلیم رو آوردهاند. همچنین ویژگیهایی چون آتشگیر نبودن و به تاخیر انداختن آتش باعث سازگاری بیشتری هلیم برای این کاربردند. با اینکه کاربرد هلیم در بالونها بسیار شناختهاست اما این مطلب تنها بخش کوچکی از کاربردهای این گاز است.کاربرد دیگر هلیم در موشکهای فضاپیما است. فضای خالی بالای جایی که سوخت قرار دارد را از هلیم پر میکنند؛ این کار باعث میشود تا هم جابجایی سوخت و اکسیدکنندهها آسان تر شود و هم بتوان با آن هیدروژن و اکسیژن را فشرده کرد تا سوخت موشک بدست آید. همچنین برای زدودن سوخت و اکسیدکنندهها از ابزارهای پیش از پرواز و پیش خنک کردن هیدروژن مایع در فضاپیما به آن نیاز است. برای نمونه موشک ساترن ۵ در برنامهٔ فضایی آپولو پیش از پرتاب به 370,000 m۳ هلیم نیاز داشت.
کاربردهای تجاری:
به این دلیل که هلیم به سختی در بافت عصبی حل میشود، از آمیختههایی مانند تریمیکس، هلیوکس و هلی ایر یا هوای هلیمی، برای غواصی در عمقهای بالای آب بهره برده میشود تا اثر فشار نیتروژن بر دستگاه عصبی بدن کاهش یابد. در عمقهای بیشتر از ۱۵۰ متر (۴۹۰ پا) اندکی هیدروژن هم به آمیختهٔ هلیم-اکسیژن افزوده میشود. چگالی بسیار پایین هلیم در این عمقها کمک میکند تا سختی تنفس کاهش یابد.
لیزر هلیم-نئون، گونهای لیزر با توان کم است با پرتوی قرمز رنگ است که کاربردهای عملی بسیاری دارد. از جملهٔ آنها می توان، بارکدخوان و اشارهگر لیزری را نام برد. البته پس از چندی این لیزر بالیزر دیودی که ارزان تر بود، جایگزین شد.
هلیم به دلیل داشتن ویژگیهایی چون: رسانش گرمایی بالا، واکنش ناپذیر بودن، neutron transparency و نساختن ایزوتوپهای پرتوزا در شرایط درون یک رآکتور، در برخی راکتورهای هستهای به عنوان گاز خنک کننده و رسانندهٔ گرما، کاربرد دارد.
آمیختهٔ هلیم با برخی گازهای سنگین تر مانند زنون دارای ضریب ظرفیت گرمایی بالا و عدد پرنتل پایین است و در سردکنندههای گرمایی صوتی (ترمواکوستیک) کاربرد دارد. ویژگی بی اثر بودن هلیم باعث شده تا برای کاهش آسیبهای زیست محیطی در سردکنندههای معمولی که اوزون تولید میکنند و باعث گرمایش زمین میشوند بکار رود.
امنیت:
هلیم طبیعی در شرایط استاندارد، آسیب رسان نیست. اندازههای بسیار اندکی از این ماده در خون انسان پیدا میشود. اگر بجای اکسیژن مورد نیاز بدن، هلیم را تنفس کنیم امکان خفگی پیش میآید. نکتههای ایمنی گفته شده دربارهٔ هلیم مایع و کار با آن همانند کار با دیگر نیتروژن مایع است. چون دمای آن بسیار پایین است و ممکن است فرد دچار سوختگی در اثر سرما شود.
اثر زیستی:
سرعت صدا در هلیم نزدیک به سه برابر بیشتر از سرعت آن در هوا است. چون بسامد پایه در گاز با سرعت صدا در گاز متناسب است. هنگامی که هلیم را تنفس میکنیم در بسامد تولیدی توسط مجرای صوتی، تشدید رخ میدهد و کیفیت صدا را تغییر میدهد. برعکس این اثر و رسیدن به بسامدهای پایین تر هم ممکن است به شرطی که گازهای سنگین تر مانند هگزا فلوراید گوگرد یا زنون را تنفس کنیم.
تنفس هلیم میتواند خطرناک باشد چون این گاز میتواند خود را جایگزین اکسیژن مورد نیاز در تنفس معمولی کند. تنفس هلیم به تنهایی هم باعث خفگی در چند دقیقه میشود. از این ویژگی در طراحی کیفهای خودکشی بهره برده میشود.
تنفس هلیمی که در کپسول فشرده شده بسیار خطرناک است چون شدت جریان آن بالا است و میتواند باعث فشارزدگی گوش میانی و پارگی ناگهانی ششها شود. البته شمار مرگ به خاطر پارگی ششها بسیار کم بودهاست برای نمونه از سال ۲۰۰۰ تا ۲۰۰۴ تنها دو مورد مرگ در آمریکا گزارش شدهاست. در سال ۲۰۱۰ هم دو مورد مرگ گزارش شدهاست که یکی در آمریکا و دیگری در ایرلند شمالی رخ داده بود.
در فشارهای بالا (بیش از ۲۰ اتمسفر یا ۲ مگاپاسکال) آمیختهای از هلیم و اکسیژن (هلیوکس) میتواند باعث مشکل در دستگاه عصبی شود (سندرم اعصاب در فشار بالا) که با افزودن مقدار اندکی نیتروژن به این آمیخته می توان مشکل را کاهش داد.
ترکيبات
هليم اولين عنصر در گروه گازهاي بي اثر است و براي بسياري از اهداف عملي واکنش ناپذير مي باشد. اما در اثر تخليه الکتريکي يا بمباران الکتروني ، ترکيباتي را با تنگستن ، يد ، فلوئور ، گوگرد و فسفر بوجود مي آورد.